



Endófitos fúngicos relacionados con la maduración natural y compuestos aromáticos en frutos de especies de la orquídea del género Vanilla.
Fungal endophytes related to natural ripening and aromatic compounds in fruits of Vanilla species
Temas Agrarios
Universidad de Córdoba, Colombia
ISSN: 0122-7610
ISSN-e: 2389-9182
Periodicidad: Semestral
vol. 27, núm. 1, 2022
Recepción: 10 Mayo 2022
Aprobación: 03 Junio 2022

Resumen: La interacción biótica entre plantas y hongos endófitos fortalece la capacidad adaptativa de los hospederos frente a perturbaciones del ambiente, y confiere a los microorganismos asociados beneficios de nutrición y protección. Estudios asociados a hongos endófitos reportan su presencia en la mayor diversidad de plantas existentes. En diferentes plantas hospederas, la interacción con hongos endófitos favorece la producción de metabolitos secundarios y fitohormonas que participan en la obtención de propiedades organolépticas como los sabores y los aromas. Sin embargo, las investigaciones desarrolladas en el género Vanilla son escasas, dificultando el entendimiento de las funciones que pueden desempeñar estos microorganismos en beneficio del hospedero. Con relación a Vanilla, los frutos de especies dentro del clado aromático se distinguen por la presencia de compuestos aromáticos, que aumentan su contenido durante la maduración. Algunos estudios, han demostrado que en los frutos de esta orquídea existen hongos endófitos posiblemente asociados al proceso de maduración que se acelera mediante el curado, pero pocos de estos estudios han evaluado la actividad de dichos hongos relacionados con la maduración del fruto de forma natural. En esta revisión se recopila literatura científica relacionada con el conocimiento de las comunidades de endófitos fúngicos y su posible aporte en la maduración y producción de compuestos aromáticos en los frutos de vainilla. Se identifican oportunidades de investigación para desarrollar futuros estudios sobre el papel de los microorganismos fungosos para la obtención de metabolitos y precursores aromáticos de los frutos en especies de Vanilla, tanto en condiciones silvestres como en cultivos comerciales.
Palabras clave: Fitohormonas, Hongos, Orquídeas, Microbioma, Metabolitos secundari.
Abstract: The biotic interaction between plants and endophytic fungi strengthens the adaptive capacity of the hosts against environmental disturbances and confers nutrition and protection benefits to the associated microorganisms. Studies associated with endophytic fungi report their presence in the majority diversity of existing plants. In hosts such as Cannabis, the interaction with endophytic fungi favors the production of secondary metabolites and phytohormones that participate in obtaining organoleptic properties such as flavors and aromas. However, the research carried out in the Vanilla genus is scarce making it difficult to understand the functions these microorganisms can perform for the benefit of the host. In relation to Vanilla, the fruits of species within the aromatic clade are distinguished by the presence of aromatic compounds, which increase their content during ripening. Some studies have shown that in this orchid fruit there are possibly endophytic fungi associated with the ripening process that is accelerated by curing, but few of these studies have evaluated the activity of these fungi related to the natural ripening of the fruit. In this review, scientific literature related to the knowledge of fungal endophyte communities and their possible contribution to the ripening and production of aromatic compounds in vanilla fruits is compiled. Research opportunities are identified to develop future studies on the role of fungal microorganisms to obtain metabolites and aromatic precursors from the fruits of Vanilla species, both in the wilds and commercial crops.
Keywords: Phytohormones, Fungi, Orchids, Microbiome, Secondary Metabolites.
INTRODUCCIÓN
Conocer sobre la interacción entre plantas y microorganismos endófitos, ha conducido al desarrollo de estudios que buscan dilucidar la diversidad de funciones en las que estos se encuentran involucrados. Particularmente, los hongos endófitos se caracterizan por residir en tejidos vegetales vivos de forma asintomática y presentar alta incidencia dentro de sus hospederos. Estos últimos, tienen la capacidad de albergar gran diversidad de especies en sus distintos órganos como hojas, tallos, raíces y frutos (Saikkonen et al., 1998; Porras-Alfaro y Bayman, 2011; Sridhar, 2019). Los hongos endófitos pueden presentar variaciones en sus funciones de acuerdo con el hospedero, el clima, el lugar y el ambiente (Sánchez-Fernández, et al. 2013; Khoyratty et al., 2015).
Dentro de sus funciones, los hongos endófitos contribuyen a la activación de mecanismos de defensa, que les permiten a las plantas soportar ataques de carácter biótico, como son la herbivoría e invasión de agentes patógenos. En cuanto a los factores abióticos, estos microorganismos ayudan al hospedero a soportar estrés por sequía, calor, salinidad, metales pesados, variación en el pH y radiación ultravioleta (Rodriguez y Redman, 2008; Porras-Alfaro y Bayman, 2011). Este conocimiento sirve de base para comprender el papel funcional de los hongos endófitos, pero aún existen vacíos de información. Aunque estos hongos son altamente diversos, se adaptan a variedad de hábitats y están presentes en distintos rangos de distribución (ubicuidad), se requieren aportes de conocimiento científico para entender las funciones que desempeñan en las plantas y su participación en la fisiología de las mismas (Khoyratty et al., 2017; Sharma et al., 2021).
En las plantas, se reconoce la presencia de rutas biosintéticas que permiten la formación de compuestos volátiles para la producción de aromas. Los aromas facilitan la interacción y respuesta del hospedero frente a diversos estímulos generados en su medio. Estas fragancias, pueden desempeñar funciones como la comunicación entre plantas, la atracción de polinizadores, la protección contra patógenos y herbívoros, entre otros (Marín-Loaiza y Céspedes, 2007). Además, nuevos estudios destacan el papel de los hongos endófitos en la obtención de estos compuestos (Gimenez et al., 2007; Khoyratty et al., 2018). Sin embargo, estos microorganismos fúngicos han recibido poca investigación sobre su potencial contribución en la maduración natural y producción de compuestos aromáticos en los frutos de plantas como Vanilla.
Aunque en los últimos años se ha investigado el papel de los hongos endófitos en la composición del sabor y el aroma del género Vanilla, la investigación se ha limitado al estudio de plantas que crecen en hábitats distintos al natural (Khoyratty et al., 2015; 2017). En consecuencia, es fundamental el desarrollo de investigaciones que centren su atención en la identificación de hongos endófitos en frutos fragantes producidos por especies silvestres de Vanilla, que se clasifican dentro del clado aromático. De este modo, se entendería el posible aporte de sus metabolitos en los procesos de maduración y producción de aromas.
De acuerdo con lo anterior, se busca revisar cuál es el adelanto generado sobre el conocimiento de los hongos endófitos y su implicación en el proceso de maduración natural, y obtención de compuestos aromáticos en frutos de especies de Vanilla.
Los objetivos de la revisión de literatura, consisten en determinar mediante búsqueda de artículos científicos, el avance en la investigación sobre hongos endófitos y su relación con la maduración y los compuestos aromáticos en frutos de Vanilla; partiendo de realizar la búsqueda de literatura científica en repositorios digitales; además de compilar reportes de literatura sobre endófitos fúngicos y su aporte en ambos procesos, para de esta forma, encontrar posibles temas de investigación futura en la producción natural de compuestos aromáticos.
DESARROLLO DEL TEMA
Importancia de la orquídea Vanilla planifolia El género Vanilla pertenece a la familia de las orquídeas, plantas que se encuentran entre las más diversas del planeta y que poseen un alto valor comercial, ornamental y medicinal. En particular, el producto natural de vainilla es muy utilizado en gastronomía, cosmética, perfumería y farmacología, entre otras industrias (Ahmad et al., 2020; Flanagan y Mosquera-Espinosa, 2016). Esto se debe, principalmente, a la vainillina, un componente presente en los frutos de las especies Vanilla planifolia, V. x tahitensis y V. pompona (Lu-binsky et al., 2008; Besse et al., 2004). Sin embargo, la principal fuente de este producto natural es la especie V. planifolia (Kanisawa et al., 1994), la cual se cultiva comercialmente en diferentes países tropicales y neotropicales como Madagascar, Indonesia, China y México, los principales productores y exportadores de este producto (FAO, 2019; Santillán et al., 2018).
En Colombia los cultivos de vainilla son incipientes, y los que existen, se desarrollan a pequeña escala en los departamentos del Valle del Cauca, Antioquia, Chocó, Magdalena y Casanare, cuyo material de propagación se importa desde centro América. Los cultivos son poco tecnificados, lo que conlleva a que se presenten graves problemas fitosanitarios (Álvarez et al., 2011).
La producción mundial de la vainilla natural ha pasado de 3984 toneladas en el año 2000 a 8342 toneladas en 2013 (FAOStat; consultado 4-4-2019). La mayor parte de la producción en 2013 fue debido a los dos países productores más grandes, Indonesia (con 3200 tn) y Madagascar (con3100tn). Otros países con producción significante son México (463tn), Papua Nueva Guinea (433tn) y China (335tn). Aunque la vainilla tiene origen en el neotrópico, entre 2010 y 2013, la producción en América sólo aportó 4.8% para el mercado mundial (Flanagan et al., 2019).
Hongos endófitos y la producción de compuestos aromáticos en plantas cultivadas y silvestres
Los hongos endófitos (HE) representan un componente importante de la diversidad fúngica global, estos microorganismos son taxonómicamente diversos y se encuentran tanto en plantas terrestres como acuáticas (Porras-Alfaro and Bayman, 2011; Backman and Sikora, 2008; Bayman, 2007). La diversidad ecológica de estos microorganismos en la naturaleza depende de diferentes factores, entre ellos (1) la disponibilidad de nutrientes, (2) las condiciones climáticas y la estacionalidad, (3) las interacciones con la microbiota externa, especialmente la microbiota presente en el suelo, (4) otros microorganismos que se encuentran en los tejidos vegetales y (5) la fenología de la planta hospedera (Rojas et al., 2020; Arnold et al., 2003).
La diversidad de plantas en el trópico y particularmente en Colombia, posibilita el aumento de la microbiota endófita incluyendo hongos, en donde una alta proporción aún carece de descripción e identificación (Banerjee, 2011). Por otro lado, a pesar de la diversidad de hospederos vegetales son pocas las investigaciones reportadas en literatura científica (se resumen en la Tabla 1), considerando la variación en la comunidad de microorganismos endófitos en los diferentes órganos vegetales (Gamboa y Bayman, 2001; Strobel, 2018).
Generalmente, se reconoce la presencia de comunidades microbianas benéficas al interior de tejidos y órganos vegetales, que pueden condicionar la elaboración de compuestos producto del metabolismo secundario sólo en presencia del hospedero. En algunas especies de Cannabis se ha identificado microbiota endófita, con capacidad de regular la producción de metabolitos secundarios en los distintos órganos de la planta (Tabla 1). Estos hongos, inducen respuestas de tipo fisiológico que desencadena la producción de precursores o compuestos bioactivos similares a los generados por el hospedero, además, de fitohormonas que mejoran los metabolitos procedentes de la misma planta (Taghinasab y Jabaji, 2020). De forma específica se indican los cannabinoides, que son compuestos terpenofenólicos que participan en la producción de aromas y sabores en Cannabis (Andre et al., 2016). En el caso de convolvuláceas, con el género Ipomoea, se reporta la producción de alcaloides como la ergolina a partir del metabolismo de endófitos fúngicos de gramíneas y hongos filamentosos como Aspergillus y Penicillium (Kucht et al., 2004; Panaccione, 2005; Ahimsa-Mueller et al., 2007; Torres et al., 2008). Estos alcaloides, son empleados en el desarrollo de fármacos para tratamiento de enfermedades cardiovasculares, neurológicas e inmunológicas. Además, contribuyen al aumento de la capacidad del huésped para evitar el ataque por plagas debido a su toxicidad (Tudzynski et al., 2001; Kucht et al., 2004; Panaccione, 2005; Ahimsa-Mueller et al., 2007). Lo anterior, muestra la interacción de endófitos fúngicos, con algunos hospederos vegetales en los que contribuyen a la producción de metabolitos secundarios, posiblemente involucrados en la obtención de características particulares, como son los sabores y aromas.
| Hospedero | Tejido | Géneros | Autores |
| Cannabis spp. | Hojas | Alternaria, Aspergillus, Aureobasidium y Penicillium. | Taghinasab y Jabaji 2020 |
| Tallo | Alternaria, Aspergillus, Cladosporium, Colletotrichum, Curvularia, Diaporthe, Penicillium y Phoma. | Taghinasab y Jabaji 2020 | |
| Semillas | Aureobasidium y Cladosporium. | Taghinasab y Jabaji 2020 | |
| Cattleyapercivaliana | Hojas | Botryotrichum, Colletotrichum, Cladosporium, Monilinia, Sclerotium y Trichoderma. | Lizarazo-Medina et al. 2015 |
| Raíces | Fusarium. | Lizarazo-Medina et al. 2015 | |
| Cattleyatrianaei | Hojas | Aureobasidium, Botryotrichum, Colletotrichum, Chromelosporium, Exophiala, Fusarium, Gonatobotrys, Monilinia, Nodulisporium, Sclerotium y Trichoderma. | Lizarazo-Medina et al. 2015 |
| Raíces | Aureobasidium, Botryotrichum, Colletotrichum, Curvularia, Fusarium, Gloeosporium, Sclerotium y Trichoderma. | Lizarazo-Medina et al. 2015 | |
| Coffea arabica | Fruto | Aspergillus, Gibberella y Penicillium. | Bolívar-Anillo et al. 2016 |
| Hospedero | Tejido | Géneros | Autores |
| Hojas | Aspergillus, Beauveria, Botryosphaeria, Cercospora, Cladosporium, Colletotrichum, Coprinus, Fusarium, Guignardia, Mucor, Penicillium, Pestalotiopsis, Rhizopus, Trichoderma y Xylaria. | Santamaría y Bayman 2005; Bolívar-Anillo et al. 2016 | |
| Coffea spp. | Hojas | Aspergillus, Beauveria, Colletotrichum, Clados- porium y Neosartorya. | Vega et al. 2010 |
| Fruto | Penicillium y Tilletia. | Vega et al. 2010 | |
| Tallo | Aspergillus, Colletotrichum y Trichoderma. | Vega et al. 2010 | |
| Raíces | Fusarium y Petriella. | Vega et al. 2010 | |
| Dendrobium spp. | Hojas | Alternaria, Acremonium, Ampelomyces, Bionectria, Colletotrichum, Cladosporium, Fusarium, Verticillium y Xylaria. | Chen et al., 2011; Sridhar, 2019 |
| Tallo | Alternaria, Acremonium, Ampelomyces, Bionectria, Colletotrichum, Cladosporium, Fusarium, Verticillium y Xylaria. | Chen et al., 2011; Sridhar 2019 | |
| Raíces | Alternaria, Acremonium, Ampelomyces, Bionectria, Fusarium, Verticillium y Xylaria. | Chen et al., 2011; Sridhar 2019 | |
| Espeletia corymbosa | Hojas | Beauveria, Chaetomium, Cladosporium, Diaporthe, Epicoccum, Eutypella, Fusarium, Hypoxylon, Nigrospora, Phoma, Scopulariopsis y Trichoderma. | Miles et al., 2012 |
| Espeletia grandiflora | Hojas | Beauveria, Bipolaris, Chaetomium, Diaporthe, Epicoccum, Eutypella, Fusarium, Nigrospora, Scopulariopsis y Trichoderma. | Miles et al., 2012 |
| Guarea guidonia | Hojas | Colletotrichum, Curvularia, Pestalotiopsis, Phomopsis, Rhizoctonia, Trichoderma y Xylaria. | Gamboa y Bayman 2001 |
| Lepanthes spp. | Hojas | Colletotrichum, Guignardia, Penicillium, Pestalotiopsis, Phoma, Trichoderma y Xylaria. | Bayman et al., 1997 |
| Raíces | Aspergillus, Colletotrichum, Guignardia, Penicillium, Pestalotiopsis y Xylaria. | Bayman et al., 1997 | |
| Rosa hybrida | Hojas | Aureobasidium, Acremonium, Alternaria, Chaetomium, Cladosporium, Gliocladium, Nodulisporium, Nigrospora, Phoma y Xylaria. | Salgado y Cepero, 2005; Bolívar-Anillo et al., 2016 |
| Vanilla planifolia | Fruto | Acremonium, Aspergillus, Botryosphaeria, Colletotrichum, Cunninghamella, Fusarium, Mycosphaerella, Nigrospora, Nemania, Pestalotiopsis y Phomopsis. | Khoyratty et al., 2015; Khoyratty et al., 2017 |
| Hojas | Colletotrichum, Fusarium, Guignardia, Nigrospora, Penicillium, Perenniporia, Sarcosomataceae y Xylaria. | Khoyratty et al., 2015; Khoyratty et al., 2017 |
Hongos fermentativos para producción del sabor y aroma en granos de plantas cultivadas
De manera particular estudios en cacao indican, que la producción del sabor y aroma en las semillas no se relaciona con hongos endófitos, en este caso es necesaria la participación de microorganismos con actividad fermentativa en los que se incluyen hongos del tipo levaduras como Candida, Kloeckera, Kluyveromyces, Lodderomyces, Pichia, Saccharomyces y Torulospora; y hongos filamentosos como Aspergillus, Fusarium, Lasiodiplodia, Mucor, Paecilomyces, Penicillium, Thielaviopsis y Trichoderma (Schwan y Wheals, 2004; Camu et al., 2008). El sabor y aroma generados durante la fermentación del grano se definen por compuestos aromáticos como ésteres pirazinas y aldehídos (Castro-Alayo et al., 2019). Estos estudios revelan, que no siempre la formación de precursores fundamentales para la obtención del aroma final característico de un producto de origen vegetal proviene de hongos endófitos, como en el caso de cacao y café, pues la actividad principal recae en la microbiota fungosa que participa de la fermentación espontánea de sus granos. Cabe resaltar, que en ausencia de la actividad microbiana no ocurre el proceso de fermentación, debido al rol fisiológico que se establece por medio de las reacciones enzimáticas necesarias para la elaboración del sabor y el aroma (Schwan y Wheals, 2004).
En los frutos del café, según Ferreira et al. (2008) y Iamanaka et al. (2014), las levaduras y hongos filamentosos contribuyen en la expresión de aromas propios del grano. Aspergillus, Cladosporium, Fusarium, Penicillium, Pestalotiopsis y Paecilomyces son fundamentales para la producción de compuestos aromáticos. Este proceso ocurre, mediante fermentación, a partir del crecimiento y activación del metabolismo de los microorganismos participantes, y de los que se obtienen ácidos orgánicos y metabolitos secundarios como furanos, pirazinas, cetonas, pirroles, fenoles, hidrocarburos, ácidos, anhídridos, aldehídos, ésteres, alcoholes y compuestos de azufre necesarios para obtener el perfil aromático (Huch y Franz, 2015; Toledo et al., 2016; Cruz-O’Byrne et al., 2020). La fermentación del grano, se describe como una actividad fundamental para la degradación de la pulpa del fruto, la elaboración del aroma y el sabor del café (Huch y Franz, 2015; Cruz-O’Byrne et al., 2020).
Maduración y curado de frutos para producción de compuestos aromáticos en Vanilla
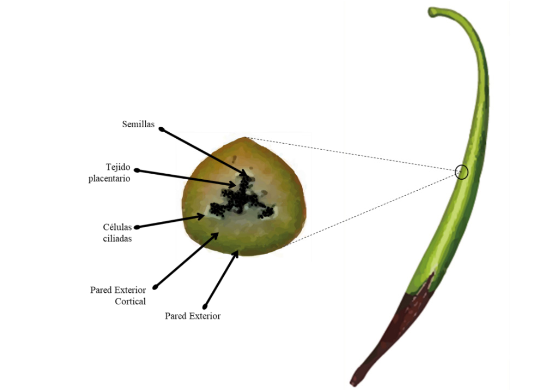
Los frutos de vainilla, son bayas dehiscentes, a las que comúnmente se les conoce como “vainillas”, debido a su similitud con el fruto de algunas leguminosas (Correll, 1953; Cameron y Soto-Arenas, 2003; Lubinsky, 2007; Molineros-Hurtado, 2012). El fruto, está conformado por la pared exterior, la pared exterior cortical, las células ciliadas, el tejido placentario y las semillas (Figura 1). De las partes del fruto se distinguen la pared del fruto y el tejido interno blanco, este último, está constituido por tres placentas parietales y tres bandas de células glandulares. Dichas placentas, son fundamentales para la obtención del sabor característico del fruto, pues es el tejido de mayor concentración de precursores aromáticos (Jones y Vicente, 1949; Havkin‐Frenkel et al., 2004).
En los frutos de vainilla, se suele observar un aumento considerable en la masa tisular, que conduce al inicio de la maduración, cuyo propósito es mediar la elaboración de compuestos precursores de sustancias, que constituyen finalmente el sabor y el aroma del fruto maduro (Frenkel et al. 2019).
Los frutos de las especies de Vanilla, generalmente se cosechan cuando aún se encuentran verdes. Estos, se someten a un proceso de curado, en el que se induce la maduración y desarrollo de componentes aromáticos. Por lo tanto, al no finalizar el proceso de maduración en su ambiente natural, es probable que la identificación de comunidades de hongos endófitos en la mayor parte de los frutos, esté relacionada con la microbiota expresada durante el curado (Roling et al., 2001; Khoyratty et al., 2017). Khoyratty et al. (2017) encontraron variación en la comunidad endofítica de hongos aislados de frutos de plantas cultivadas en proceso de maduración, en donde al inducir el curado se recuperó únicamente el hongo endófito Hypoxylon investiens.
Métodos para el curado de frutos devainilla
Con relación al fruto de vainilla, su importancia económica radica en la concentración de vainillina y más de 200 compuestos aromáticos, que en conjunto constituyen el sabor y aroma a vainilla (Sabik et al., 2016; Xu et al., 2020). Por ello, la maduración de las vainas es un proceso fundamental para la obtención de dichos compuestos, ya que su contenido aumenta al producirse un avance en la maduración de los frutos. Este proceso generalmente ocurre de ocho a diez meses cuando los frutos aún están soportados en la planta (Khoyratty et al., 2018). Sin embargo, comercialmente la maduración es inducida por el curado, y según Toth et al. (2018), el aroma y el sabor a vainilla experimentan una transición gradual a medida que los frutos atraviesan por este proceso. Por ello, el perfil aromático de la vainilla se acentúa cuando los frutos alcanzan su maduración completa, ya sea a nivel natural o inducido por el proceso de curado.
De acuerdo a Dignum et al. (2001), el proceso de curado, es considerado una simulación de la senescencia que ocurre en el fruto adherido a la planta, es decir, es el avance en el desarrollo y maduración de las vainas en ambiente natural. Por ello, Frenkel et al. (2019) consideran, que tanto la senescencia como el curado, podrían reconocerse como procesos análogos que favorecen la elaboración del sabor y el aroma derivados de los frutos de especies de Vanilla.
En la literatura se describen distintas metodologías para llevar a cabo el proceso de curado o maduración inducida de los frutos de vainilla, cuya finalidad es la formación del sabor, aroma y preservación de las vainas. Uno de los procesos pioneros es el curado tradicional mexicano. Este se caracteriza por exponer los frutos a altas temperaturas utilizando el sol u hornos. También está el proceso Bourbon, que se adapta por la inmersión de las vainas en agua caliente (escaldado). Otras prácticas de curado, son consideradas variantes de estas dos (Hernández-Hernández, 2011; Quirós, 2011; Frenkel et al., 2019).
A nivel mundial, actualmente países como Madagascar, Indonesia, isla Reunión (Francia), India, islas Comoras y el estado independiente de Papúa Nueva Guinea, son los mayores productores de vainilla. Estos países, implementan el proceso de curado para la obtención del producto comercial final que son vainas curadas (Frenkel et al., 2019). En el proceso se describen cuatro etapas fundamentales: 1. El marchitamiento de la vaina, origina desorden tisular que conlleva a la detención de las actividades vitales y metabólicas al interior del tejido del fruto. 2. El sudor de la vaina, logra disminuir el contenido de agua estabilizando la humedad requerida (entre 60-70%) para catalizar reacciones de hidrólisis y oxidación, que se hacen evidentes en la tonalidad marrón de las vainas. 3. Inicio del secado de las vainas, para alcanzar la humedad final cercana al 30% del peso del fruto. 4. Acondicionamiento de la vaina, los frutos se almacenan para obtener el perfil aromático terminado. Generalmente, el curado presenta una duración aproximada de tres a seis meses, y depende de las variaciones incluidas en el proceso de acuerdo con la región de producción (Hernández-Hernández 2011; Frenkel et al. 2019).
Hongos endófitos y producción de compuestos aromáticos en frutos de vainilla
El avance en la investigación sobre el posible aporte de hongos endófitos en la maduración natural y producción de compuestos aromáticos en frutos de especies de Vanilla silvestre, es escaso (Frenkel et al., 2019). Los estudios asociados a la identificación de hongos endófitos en frutos de especies de Vanilla, han sido desarrollados en plantas cultivadas y mayormente basados en el proceso de curado; en ambas condiciones se han reportado diferencias en las comunidades de endófitos fúngicos aislados (Roling et al., 2001; Khoyratty et al., 2017). Es posible que los frutos que crecen bajo condiciones naturales presenten variación en las comunidades de endófitos fúngicos. Pero, poco se conoce sobre estos microorganismos y su implicación en el desarrollo del aroma en los frutos de especies silvestres del género Vanilla (Flanagan et al., 2019)
Las especies silvestres de Vanilla dentro del clado aromático, conforman el acervo genético secundario de Vanilla, en el que se agrupan 44 especies, que se distribuyen desde Florida hasta el norte de Argentina (Soto-Arenas y Cribb, 2010; Flanagan et al., 2019). En el caso de Colombia, se encuentran poblaciones del clado aromático de Vanilla: Vanilla planifolia, V. calyculata, V. odorata, V. helleri, V. pompona entre otras (Flanagan et al., 2019). Estas especies crecen en condiciones silvestres particulares, principalmente en tierras bajas del chocó biogeográfico, valles interandinos y región amazónica. Por lo tanto, las poblaciones silvestres de vainilla en el país, son un recurso fundamental para el estudio del microbioma y sus aportes para la adaptación de estos hospederos en condiciones naturales (Flanagan y Mosquera-Espinosa, 2016; Flanagan et al., 2019). Se reconoce entonces, la importancia de adelantar investigaciones asociadas al conocimiento de comunidades de hongos endófitos en frutos de especies de Vanilla, haciendo uso de herramientas microbiológicas, bioquímicas, moleculares y de metabólica. De este modo, se profundiza sobre el posible papel de los hongos endófitos en la maduración, y obtención de compuestos aromáticos asociados a este importante género de planta.
La presencia de hongos endófitos en Vanilla se puede expresar, a través del mejoramiento y adaptación de las plantas en relación a condiciones biótica y abióticas poco favorables para su establecimiento (Rodriguez y Redman, 2008). Sin embargo, es un tema relevante reconocer la existencia y participación de microorganismos en los frutos durante la etapa de curado y que promueve la producción de precursores como la vainillina y un sabor general, asociado a su capacidad de bioconversión de glucósidos (Ranadive, 1994; Roling et al., 2001). Reportes de Xu et al. (2020), mencionan que el género Aspergillus fue identificado de forma predominante durante todas las etapas de curado, sugiriendo que este microorganismo fúngico desempeña un rol fundamental en la obtención del sabor en las vainas. Por otro lado, Khoyratty et al. (2015) aislaron hongos endófitos provenientes de frutos de vainilla cultivada en etapa de maduración. Estos hongos se inocularon en medios de cultivo suministrados con frutos molidos de vainilla verde, con el fin de evaluar su capacidad de biotransformación de precursores o metabolitos implicados en la composición del aroma y sabor a vainilla. Este estudio encontró que los hongos Pestalotiopsis microspora y Diaporthe phaseolorum se relacionaron directamente con un aumento en la producción de vainillina, p-hidroxibenzaldehído, alcohol vanílico y otros compuestos aromáticos. A su vez, reportes de Khoyratty et al. (2018) mencionan que para la producción de vainillina se han empleado hongos endófitos con potencial para biotransformar o biosintetizar precursores de este metabolito aromático.
De igual forma, en ensayos in vitro e in vivo realizados en frutos de Vanilla planifolia, se encontró que los endófitos fúngicos Diaporthe phaseolorum, Hypoxylon investiens y Pestaloptiosis miscrospora se involucran en la síntesis de compuestos aromáticos, y aumentan las cantidades de metabolitos que conforman el sabor y el aroma a vainilla; como son el alcohol vanilílico, ácido p-hidroxibenzoico, ácido p-cumárico, vainillina, p-xileno, p-hidroxibenzaldehído, α-felandreno, α-terpineol, α-cubeneno, β-cariofileno y 3-careno (Khoyratty, 2020). Estos resultados sugieren que los hongos endófitos pueden producir compuestos aromáticos, por lo tanto, estos microorganismos podrían contribuir en la formación de los aromas y sabores terminados en frutos de vainilla.
Probablemente, la capacidad que poseen los microorganismos endófitos de generar metabolitos secundarios y fitohormonas, se deba a la estrecha relación que establecen con el metaboloma de su hospedero. Por lo tanto, es fundamental considerar la hipótesis de que algunos aromas y sabores procedentes de las plantas, son posiblemente producto de estos microorganismos con alto aporte de los hongos endófitos (Bálint et al., 2013).
Diversidad de endófitos fúngicos y la producción de sustancia multifuncionales sin explorar
La producción de metabolitos secundarios y precursores aromáticos para la obtención del sabor a vainilla, no son generados de forma exclusiva por las plantas, ya que los endófitos fúngicos pueden participar en las rutas biosintéticas de su hospedero vegetal, para la generación compuestos aromáticos completa o parcialmente (Khoyratty et al., 2018; 2022). Así mismo, Khoyratty et al. (2017) mencionan algunos hongos endófitos con capacidad de producir estas sustancias, destacándose principalmente los géneros Aspergillus, Acremonium, Botryosphaeria, Colletotrichum, Diaporthe, Fusarium, Hormodendrum, Mycosphaerella, Nemania, Nigrospora, Paecilomyces, Pestalotiopsis, Penicillium, Perenniporia, Phomopsis, Purpureocillium y Xylaria.
Por su parte, la especie Aspergillus niger como endófito, ha obtenido un mayor rendimiento en la cantidad de vainillina sintetizada respecto a otros microorganismos. De igual forma, este endófito representa una fuente potencial para la obtención del componente principal del aroma y sabor a vainilla, reduciendo a su vez los costos derivados de su producción (Kaur y Chakraborty, 2013).
Por otra parte, microorganismos como los hongos han secretado hormonas vegetales incluso antes que las plantas (Tudzynski, 1997). En este sentido, se muestra de forma indirecta su contribución al desarrollo del hospedero mediante el proceso de maduración, al poner a disposición de la planta sustancias como el etileno, que se involucra en el desarrollo de los frutos. Es así, como dentro de los géneros de hongos que producen etileno se nombran específicamente a Colletotrichum, Fusarium y Penicillium (División: Ascomycota), como también, especies dentro de la división Zygomycota (Tudzynski y Sharon, 2002). Mishra et al. (2019) identifican diversos hongos endófitos existentes a nivel mundial. Se estima que estos corresponden a aproximadamente 800 géneros. Dentro de estos con mayor incidencia en hospederos vegetales respecto a otros están: Alternaria, Aspergillus, Colletotrichum, Fusarium, Penicillium y Phoma. Lo anterior se relaciona, con la alta capacidad de estos hongos para adaptarse y desarrollar compuestos que actúan como metabolitos primarios y secundarios (Mishra y Sarma, 2018; Mishra et al., 2019). En cuanto a los hongos endófitos aislados de frutos de vainilla cultivada, se mencionan géneros como Acremonium, Aspergillus, Botryosphaeria, Colletotrichum, Diaporthe, Fusarium, Hormodendrum, Mycosphaerella, Nemania, Nigrospora, Paecilomyces, Pestalotiopsis, Penicillium, Perenniporia, Phomopsis, Purpureocillium, Xylaria, entre otros (Khoyratty et al., 2017).
CONCLUSIONES
Los estudios sobre hongos endófitos en tejidos de plantas, indican el papel fundamental de estos microorganismos en la producción de metabolitos secundarios y fitohormonas que el hospedero puede emplear en los procesos de adaptación a su hábitat superando estrés biótico y abiótico. De igual manera se entiende, que comunidades fúngicas fermentativas y endófitas aportan en la obtención de aromas y sabores en productos de importancia económica como la el café y el cacao, como también la vainilla, respectivamente. Lo anterior, permite identificar una oportunidad de investigación con relación a los metabolitos generados por hongos endófitos, y su función en procesos como la obtención de compuestos aromáticos y la maduración natural de frutos de poblaciones silvestres de Vanilla en Colombia.
Reconocer que existe este vacío en la generación de conocimiento fundamentado en la investigación sobre aportes y uso de la relación microorganismo-planta, es fundamental para apoyar la producción de información científica básica y aplicada. Lo anterior, permitiría complementar estrategias de conservación de plantas en general y de manera específica, como ocurre para orquídeas dentro del género Vanilla por su alta demanda económica a nivel mundial por sus compuestos aromáticos naturales.
Agradecimientos
Los autores agradecen el apoyo a la Oficina de Investigación y Desarrollo, de la Pontificia Universidad Javeriana Cali, mediante el proyecto número 020100655 que contribuye al programa de Investigación para la conservación y uso sostenible de la vainilla en Colombia, bajo la dirección de Nicola S. Flanagan y Ana T. Mosquera-Espinosa docentes-investigadoras en PUJC.
REFERENCIAS
Ahmad, H., Ahmad, R., Asif, M., Adnan, M. and Idrees, M. 2020. Vanilla. In: Asif, M., Nawaz, H., Mumtaz, M., Byrne, M., (Eds.) Medicinal Plants of South Asia. Elsevier. 657-669. ISBN 9780081026595.https://doi.org/10.1016/B978-0-08-102659-5.00048-3.
Ahimsa-Mueller, M., Market, A., Hellwig, S., Knoop, V., Steiner, U., Drewke, C. and Leistner, E. 2007. Clavicipitaceous fungi associated with ergoline alkaloid containing convolvulaceae. J Nat Prod 70:1955–1960.doi:10.1021/np070315t
Álvarez, C., Santa. C., Ordoñez, N.F., Posa- da, LP., Diez, M.C., Osorio, N.W., Marín, M.A. and Otero J.T. 2011. Sanidad del cultivo de vainilla (59-61). En. Moreno, F. y Diez, M.C. (eds.). Cultivo de Vainilla, contribuciones para el desarrollo de su cadena productiva en Colombia. Universidad Nacional de Colombia - Medellín.108 pp.
Andre, C., Hausman, J. and Guerriero, G. 2016. Cannabis sativa: the plant of the thousand and one molecules. Front Plant Sci 7:1-17. doi: 10.3389/fpls.2016.00019
Backman, P. and Sikora, R. 2008. Endophytes: An emerging tool for biological control. Biol. Control. 46, 1-3. https://doi.org/10.1016/j.biocontrol.2008.03.009
Bálint, M., Ti.n, P., Hallström, B., O’Hara, R., Olson, M., Fankhauser, J., Piepenbring, M. and Schmitt, I. 2013. Host genotype shapes the foliar fungal microbiome of balsam poplar (Populus balsamifera). Plos One 8:1-9. Doi: 10.1371/journal.pone.0053987
Banerjee, D. 2011. Endophytic fungal diversity in tropical and subtropical plants. Res J Microbiol 6:54-62.
Bayman, P. 2007. Fungal Endophytes. In: Kubicek, C. y Druzhinina, I. (Eds.), Environmental and Microbial Relationships, The Mycota IV. 2nd Edition. Springer, Berlin, Heidelberg, pp. 213- 227.
Bayman, P., Lebrón, L., Tremblay, R. and Lodge, D. 1997. Endophytic fungi in roots and leaves of Lepanthes (Orchidaceae). New Phytol 135:143–149.
Besse, P., Silva, D., Bory, S., Grisoni, M., Le Bellec, F. and Duval, M. 2004. RAPD genetic diversity in cultivated vanilla: Vanilla planifolia, and relationships with V. tahitensis and V. pompona. Plant Science, 167(2), 379–385. https://doi.org/10.1016/ j.plantsci.2004.04.007
Bolívar-Anillo, H., Orozco-Sánchez, C., Da Silva, G. and Franco, G. 2016. Endophytic microorganisms isolated of plants grown in Colombia: a short review. J Microb Biochem Technol 8:509-513. Doi: 10.4172/1948-5948.1000335
Cameron, K. and Soto Arenas, M. 2003. Vanilloideae. In: Pridgeon, A., Cribb, P., Chase, M. and Rasmussen, F. (Eds). Genera Orchidacearum, volume 3: Orchidoideae (part 2), Vanilloideae. Oxford University Press, Oxford, pp. 281–334.
Camu, N., De Winter, T., Addo, S., Takrama, J., Bernaert, H. and De Vuyst, L. 2008. Fermentation of cocoa beans: influence of microbial activities and polyphenol concentrations on the flavour of chocolate. J Sci Food Agric 88:2288–2297. Doi: 10.1002/jsfa.3349
Castro-Alayo, E., Idrogo-Vásquez, G., Siche, R. and Cardenas-Toro, F. 2019. Formation of aromatic compounds precursors during fermentation of Criollo and Forastero cocoa. Heliyon 5(1): 1-29.
Correll, D. 1953. Vanilla Its botany, history, cultivation and economic import. Econ Bot 7:291–358. Doi: 10.1007/BF02930810
Cruz-O’Byrne, R., Piraneque-Gambasica, N. and Aguirre-Forero, S. 2020. Physicochemical, microbiological, and sensory analysis of fermented coffee from Sierra Nevada of Santa Marta, Colombia. Coffee Sci 15: 1-6.
Dignum, M., Kerler, J. and Verpoorte, R. 2001. β‐Glucosidase and peroxidase stability in crude enzyme extracts from green beans of Vanilla planifolia Andrews. Phytochem Anal 12:174–179. Doi: 10.1002/pca.578
Ferreira, C., Batista, L., Magalhaes, L., Souza, E. and Freitas, R. 2008. Succession of bacterial and fungal communities during natural coffee (Coffea arabica) fermentation. Food Microbiol 25:951–957.
Flanagan, N.S., Chavarriaga, P. and Mos- quera-Espinosa, A.T. 2019. Conservation and Sustainable Use of Vanilla Crop Wild Relatives in Colombia. In: Havkin-Frenkel, D., Belanger, F. (Eds). Handbook of VanillaScience and Technology, 2nd edn. Wiley Blackwell, New Jersey, pp. 85-109.
Flanagan, N.S. and Mosquera-Espinosa, A.T. 2016. An integrated strategy for the conservation and sustainable use of native Vanilla species in Colombia. Lankesteriana 16: 201–218.
Food and Agriculture Organization Data (FAOSTAT). 2019. Vanilla Production.
Frenkel, C., Ranadive, A., Tochihuitl, J. and Havkin-Frenkel, D. 2019. Curing of Vanilla. In: Havkin-Frenkel, D. and Belanger, F. (Eds). Handbook of Vanilla Science and Technology, 2nd edn. Wiley Black- well, New Jersey, pp. 191-216.
Gamboa, M. and Bayman, P. 2001. Communities of endophytic fungi in leaves of a tropical timber tree (Guarea guidonia: Meliaceae). Biotropica 33(2): 352-360.
Gimenez, C., Cabrera, R., Reina, M. and Gonzalez-Coloma, A. 2007. Fungal endophytes and their role in plant protection. Curr Org Chem 11(8): 707–720. Doi: 10.2174/138527207780598765
Havkin-Frenkel, D., French, J., Graft, N., Pak, F., Frenkel, C. and Joel, D. 2004. Interrelation of curing and botany in vanilla (Vanilla planifolia) bean. Acta Hortic 629:93–102.
Hernández-Hernández, J. 2011. Mexican Vanilla Production. In: Havkin‐Frenkel, D. and Belanger, F. (Eds.. Handbook of Vanilla Science and Technology, 2nd edn. Wiley Blackwell, New Jersey, pp. 3–24.
Huch, M. and Franz, C. 2015. Coffee: fermentation and microbiota. In: Holzapfel W (ed) Advances in Fermented Foods and Beverages, Woodhead Publishing, German, pp. 501-513.
Iamanaka, B., Teixeira, A., Teixeira, A., Copetti, M., Bragagnolo, N. and Taniwaki, M. 2014. Reprint of “the mycobiota of cof- fee beans and its influence on the coffee beverage.” Food Res Int 61:33–38. Doi: 10.1016/j.foodres.2014.05.023
Jones, M. and Vicente, G. 1949. Criteria for testing vanilla in relation to killing and curing methods. J Agric Res 78: 425–434.
Kaur, B. and Chakraborty, D. 2013. Biotechnological and molecular approaches for vanillin production: a review. Appl Biochem Biotechnol 169:1353–1372. Doi: 10.1007/s12010-012-0066-1
Kanisawa, T., Tohoro, K. and Kawakara, S. 1994. Flavour development in the beans of Vanilla planifolia. In: Kurihara, K., Suzuki, N., Ogawa, H. (Eds.), Olfactionand Taste
Khoyratty, S. 2020. Potential interference of fungal endophytes in Vanilla planifolia on vanilla flavor compounds biosynthesis. Doctoral dissertation. Leiden University.
Khoyratty, S., Choi, Y., Dupont, J., Ver- poorte, R. and Kodja, H. 2017. Host and guest: vanilla inhabited by endophytes. Mérillon, J. and Ramawat, K. (Eds). Fungal Metabolites. Switzerland, pp. 191- 217.
Khoyratty, S., Dupont, J., Lacoste, S., Palama, T., Choi, Y., Kim, H., Payet, B., Grisoni, M., Fouillaud, M., Verpoorte, R. and Kodja, H. 2015. Fungal endophytes of Vanilla planifolia across Réunion Island: isolation, distribution and biotransformation. BMC Plant Biol 15:142.
Khoyratty, S., Kodja, H. and Verpoorte, R. 2018. Vanilla flavor production methods: a review. Ind Crop Prod 125: 433–442. Doi: 10.1016/j.indcrop.2018.09.028
Khoyratty, S., Verpoorte, R. and Kodja, H. 2022. Vanillin: Biosynthesis, Biotechnology, and Bioproduction. In: Mérillon, J. and Kodja, H. (Eds). Orchids Phytochemistry, Biology and Horticulture. Springer, Cham, pp. 341-358.
Koehler, A. 1887. La vainilla, la orquídea Vanilla planifolia. In: Pabst G, Koehler A (eds) Chromolithograph tras una ilustración botánica de Hermann Adolph Koehler de Plantas Medicinales. Alemania.
Kucht, S., Groß, J., Hussein, Y., Grothe, T., Keller, U., Basar, S., König, W., Steiner, U. and Leistner, E. 2004. Elimination of ergoline alkaloids following treatment of Ipomoea asarifolia (convolvulaceae) with fungicides. Planta 219:619–625. Doi: 10.1007/s00425-004-1261-2
Lizarazo-Medina, P., Mendoza-Salazar, M. y Gutiérrez-Gallo, A. 2015. Diversidad de la micobiota endófita de Cattleya percivaliana . Cattleya trianaeicultivadas en invernadero. Actual Biol 37(102): 307-318.
Lubinsky, P., Bory, S., Hernández-Hernández, J., Kim, C. and Gómez, A. 2008. Origins and dispersal of cultivated Vanilla .Vanilla planifolia Jacks. [Orchidaceae]). Econ. Bot. 62(2), 127-138.
Lubinsky, P. 2007. Historical and evolutionary origins of cultivated vanilla. University of California, Riverside. California.
Marín-Loaiza, J. y Céspedes, C. 2007. Compuestos volátiles de plantas. Origen, emisión, efectos, análisis y aplicaciones al agro. Rev Fitotec Mex 30(4): 327-351. https://www.redalyc.org/articulo.oa?id=61030401
Miles, L., Lopera, C., González, S., Cepero, M., Franco, A. and Restrepo, S. 2012. Exploring the biocontrol potential of fungal endophytes from an Andean Colombian Paramo ecosystem. BioControl 57(5): 697-710. Doi: 10.1007/s10526-012-9442-6
Mishra, R., Kushveer, J. and Sarma, V. 2019. A worldwide list of endophytic fungi with notes on ecology and diversity. My- cosphere 10(1): 798–1079. Doi: 10.5943/mycosphere/10/1/19
Mishra, R. and Sarma, V. 2018. Current perspectives of endophytic fungi in sustainable development. In: Gehlot, P. and Singh, J. (Eds). Fungi and their role in sustainable development: current perspectives. Springer, Singapoure, pp. 553- 584.
Molineros-Hurtado, F. 2012. Caracterización morfológica y filogenia del género Vanil- la en el distrito de Buenaventura–Valle del Cauca (Colombia). Tesis de maestría en Ciencias Biológicas, línea de investigación recursos fitogenéticos neotropicales. Universidad Nacional de Colombia, sede Palmira.
Panaccione, D. 2005. Origins and significance of ergot alkaloid diversity in fungi. FEMS Microbiology Letters. 251: 9–17. Doi: 10.1016/j.femsle.2005.07.039
Porras-Alfaro, A. and Bayman, P. 2011. Hidden fungi, emergent properties: endophytes and microbiomes. Annu Rev Phytopathol 49: 291–315. Doi:10.1146/annurev-phyto-080508-081831
Quirós, E. 2011. Vanilla production in Costa Rica. Havkin‐Frenkel, D. and Belanger, F. (Eds). Handbook of Vanilla Science and Technology, 1st edn. Wiley Blackwell, New Jersey, pp. 41–51.
Ranadive, A. 1994. Vanilla‐cultivation, curing, chemistry, technology and commercial products. In: Charalambous, G. (Ed.). Spices herbs and edible fungi. Developments in food science, Elsevier Science Publishers BV, Amsterdam, the Netherlands, pp. 517–577.
Reyes-López, D., Flores-Jiménez, A., Huerta-Lara, M., Kelso-Bucio, C., Avedaño-Arrazate, H., Lobato-Ortíz, R., Aragón-García, A. and López-Olguín, J. 2014. Morfometric variation of fruis and seed in four species of the genus Vanilla. Agric Ecosyst Environ 1(3): 205-218.
Rodriguez, R. and Redman, R. 2008. More than 400 million years of evolution and some plants still can’t make it on their own: plant stress tolerance via fungal symbiosis. J Exp Bot59(5): 1109–1114. Doi: 10.1093/jxb/erm342
Roling, W., Kerler, J., Braster, M., Apriyantono, A., Stam, H. and Van Verseveld, H. 2001. Microorganisms with a taste for vanilla: microbial ecology of traditional Indonesian vanilla curing. Appl Environ Microbiol 67(5): 1005-2003. Doi: 10.1128/AEM.67.5.1995-2003.2001
Sabik, H., Pérez-Silva, A., Bélanger, D., Vivar-Vera, M., García, N. and Reyes- López, D. 2016. Identification of volatile compounds in cured mexican vanilla (Vanilla planifolia G. Jackson) beans using headspace solid phase microextraction with gas chromatographymass spectrometry. Fruits71(6): 407-418. Doi: 10.1051/fruits/2016032
Saikkonen, K., Faeth, S., Helander, M. and Sullivan, T. 1998. Fungal endophytes: a continuum of interactions with host plants. Annu Rev Ecol Evol Syst 29: 319–343. Doi: 10.1146/annurev.ecolsys.29.1.319
Salgado, C. and Cepero, M. 2005. Aislamiento de hongos endófitos en rosa (Rosa hybrida) en Bogotá, Colombia. Rev Iberoam Micol 22: 99-101. Doi: 10.1016/S1130-1406(05)70016-4
Sánchez-Fernández, R., Sánchez, B., Sandoval-Espinosa, Y., Ulloa-Benítez, A., Armendáriz-Guillén, B., García, M. y Macías-Rubalcava, M. 2013. Hongos endófitos: fuente potencial de metabolitos secundarios bioactivos con utilidad en agricultura y medicina. TIP Revista Especializada en Ciencias Químico Biológicas 16(2): 132-146.
Santamaría, J. and Bayman, P. 2005. Fungal epiphytes and endophytes of coffee leaves (Coffea arabica). Microb Ecol. 50 (1), 1–8. Doi: 10.1007/s00248-004-0002-1
Santillán, A., Salas, A. and Vásquez, N. 2018. La productividad de la vainilla (Vanilla planifolia Jacks. Ex Andrews) en México de 2003 a 2014. Rev. Mex. Cien. Fores. 9(47), 50-69. https://doi.org/10.29298/rmcf.v9i47.165
Schwan, R. and Wheals, A. 2004. The microbiology of cocoa fermentation and its role in chocolate quality. Crit Rev Food Sci Nutr 44(4): 205-221.
Sharma, H., Rai, A., Dahiya, D., Chettri, R. and Nigam, P. 2021. Exploring endophytes for in vitro synthesis of bioactive compounds similar to metabolites produced in vivo by host plants. AIMS microbiology 7(2): 175. Doi: 10.3934/microbiol.2021012
Soto-Arenas, M. and Cribb, P. 2010. A new infrageneric classification and synopsis of the genus Vanilla Plum. ExMill (Orchidaceae: Vanillinae). Lankesteriana 9:355–398. Doi: 10.15517/LANK.V0I0.12071
Sridhar, K. 2019. Diversity, Ecology, and Significance of Fungal Endophytes. Endophytes and Secondary Metabolites 61–100. Doi: 10.1007/978-3-319-76900-4_5-1
Strobel, G. 2018. The emergence of endophytic microbes and their biological promise. J Fungi 4(57): 1-19.
Taghinasab, M. and Jabaji, S. 2020. Cannabis microbiome and the role of endophytes in modulating the production of secondary metabolites: an overview. Microorganisms 8(355) 1-15. Doi: 10.3390/microorganisms8030355
Toledo, P., Pezza, L., Pezza, H. and Toci, A. 2016. Relationship between the different aspects related to coffee quality and their volatile compounds. Compr Rev Food Sci Food Saf 15(4): 705–719. Doi: 10.1111/1541-4337.12205
Torres, M., Singh, A., Vorsa, N. and White, J. 2008. An analysis of ergot alkaloids in the Clavicipitaceae (Hypocreales, Ascomycota) and ecological implications. Symbiosis 46(1): 11-19.
Toth, S., Joong, K., Havkin-Frenkel, D., Belanger, F. and Hartman, T. 2018. Volatile compounds in Vanilla. In: Havkin-Frenkel, D. and Belanger, F. (Eds). Handbook of Vanilla Science and Technology, 2nd edn. Wiley Blackwell, New Jersey, pp. 285-345.
Tudzynski, B. 1997. Fungal phytohormones in pathogenic and mutualistic associations. In: Carroll, G. and Tudzynski, P. (Eds). The mycota V. Part A: plant relationships. Springer, Berlin Heidelberg, New York, pp. 167- 184.
Tudzynski, B. and Sharon, A. 2002. Biosynthesis, biological role and application of fungal phytohormones. The mycota X Industrial applications 183–212. Doi: 10.1007/978-3-662-10378-4_9
Tudzynski, P., Correia, T. and Keller, U. 2001. Biotechnology and genetics of ergot alkaloids. Appl Microbiol Biotechnol 57: 593– 605. Doi: 10.1007/s002530100801
Vega, F., Simpkins, A., Aime, M., Posada, F., Peterson, S., Rehner, S., Infante, F., Castillo, A. and Arnold, E. 2010. Fungal endophyte diversity in coffee plants from Colombia, Hawai’i, México and Puerto Rico. Fungal Ecol 3: 122-138. https://doi.org/10.1016/j.funeco.2009.07.002
Xu, F., Chen, Y., Cai, Y., Gu, F. and An, K. 2020. Distinct roles for bacterial and fungal communities during the curing of vanilla. Front Microbiol 11:552388. Doi: 10.3389/fmicb.2020.552388
Información adicional
Conflicto de intereses: Los autores declaran que es un trabajo original
y no existió conflicto de intereses de ningún tipo en la elaboración y publicación del manuscrito

